Батукаев А.А.
Агротехнологический институт ЧГУ
Чеченский НИИ сельского хозяйства
Биотехнологические методы в системе производства оздоровленного посадочного материала винограда
Современное виноградарство России должно базироваться на производстве сертифицированного посадочного материала. Основная цель исследований заключалась в совершенствовании технологий клонального микроразмножения с использованием регуляторов роста. Задача состоит в получении здорового посадочного материала винограда и введение системы сертификации посадочного материала по образцу европейских стран.
Технология производства оздоровленного посадочного материала в качестве составной части включает биотехнологические приемы, комплексное оздоровление с использованием культуры изолированных апексов, ускоренное размножение оздоровленных экземпляров на искусственных питательных средах и создание коллекций оздоровленных форм in vitro
К основным преимуществам использования биотехнологических приемов можно отнести следующие:
- возможность получения оздоровленного от вирусов и бактериального рака посадочного материала;
- быстрое размножение ценных клонов;
- возможность работы в течении всего года и планирование выпуска материала к определенному сроку;
- при интродукции растений устраняется вероятность завоза и распространения карантинных растений;
- паспортизация сортов и форм с помощью молекулярно-генетического маркирования и установление филлогенетических связей;
- длительное хранение материала в условиях in vitro.
Объекты и методы исследований
Объектом исследований явились комплексно-устойчивые сорта винограда селекции Всероссийского НИИВиВ имени Я.И.Потапенко, НИВиВ «Магарач» Украинской академии аграрных наук, молдавской, венгерской селекции и др.
В качестве исходного материала были взяты интенсивно растущие зеленые побеги винограда, которые разрезали на одноглазковые черенки и далее проводили вычленение меристем в ламинарных боксах.
Одноглазковые черенки перед вычленением меристемы стерилизовали в 2 %-м растворе гипохлорита натрия. Простерилизованные органы помещали в стерильную чашку Петри. Перед вычленением с верхушки глазка удаляли покровные чешуи, последовательно обнажая верхушечную меристему с примордиальными листочками. Эту операцию проводили с помощью препаровальной иглы под стереоскопическим микроскопом МБС-10, установленным в пылезащитной камере (ламинар-боксе). Вычленяли меристемы от 200 до 400 микрон специальной препаровальной иглой и немедленно помещали на поверхность агаризованной среды в чашки Петри, которые в свою очередь были размещены в культуральной комнате с соответствующими условиями: освещенность 3…4 тыс. люкс, температура 27…28С, относительная влажность воздуха 65…70 %.
При этом использовали модифицированную питательную среду MS (Мурасиге и Скуга) с витаминами: тиамин — 1 мг/л, пиридоксин — 1 мг/л, никотиновая кислота — 1 мг/л, мезоинозит — 50 мг/л, источник углерода (сахароза) — 2 %, агар — 0,7 % и доводили рН до 6,4…6,5.
В качестве регуляторов роста в питательную среду добавляли ауксины и цитокинины в различных концентрациях и сочетаниях. Из группы ауксинов было изучено влияние индолил-масляная кислота (ИМК) и индолил-уксусная кислота (ИУК), из группы цитокининов: 6-бензиламинопурин (6-БАП), 2-изопентил-аденин (2iP), кинетин, а также гибберелловая кислота (ГК).
Культивирование растительного материала осуществляли на первом этапе в чашках Петри, далее в пробирках размером 40 х 120 мм, содержащих 20 мл питательной среды.
Результаты исследований
Проведенные наблюдения показали, что на первом этапе выращивания (2 недели) часть меристем (40-60% в зависимости от сорта), начали некротизировать. Оставшиеся меристемы через месяц после посадки развились в микропобеги размерами 2…2,5 мм. Эти микропобеги повторно пересаживали на такую же по составу питательную среду. Пересадку производили в биологические пробирки.
Степень приживаемости апикальных меристем на этапе введения в культуру in vitro находится в среднем на уровне 40-50%.
Прижившиеся апикальные меристемы, через месяц после посадки были пересажены на питательную среду с содержанием тех же компонентов. Пересадку производили в биологические пробирки размером 40 х 120 мм, в течение 45…55 дней образовались регенеранты размерами 6…10 см. Далее эти микрорастения были расчеренкованы и получены микроклоны.
На этапе пересадки кластер-побегов приживаемость их достаточно высокая (75-90%). В течение 45-50 дней образовались регенеранты растений размерами 6…10 см. Далее мы приступили к их клональному микроразмножению. Растения-регенеранты разрезали на фрагменты, включавшие узел с листом и почкой (нижняя часть междоузлия длиннее верхней на 1…2 см). Полученные микрочеренки высаживали в биологические пробирки (40 х 120 мм) на агаровую среду.
Влияние регуляторов роста на развитие эксплантов винограда в условиях in vitro
Одним из важнейших и неотъемлемых компонентов питательной среды являются регуляторы роста. Их тщательный подбор и выявление оптимальных концентраций позволяют повысить эффективность метода in vitro.
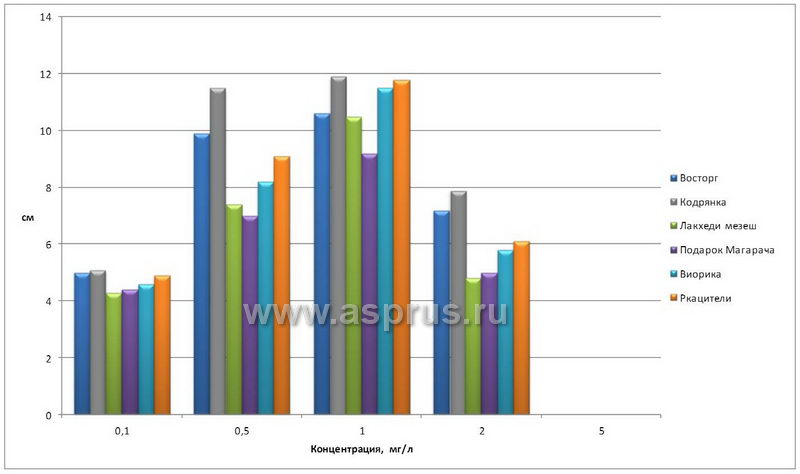
Проведенные эксперименты показали, что регенерация побегов происходила при всех концентрациях 6-БАП, кроме как при добавке препарата в количестве 5,0 мг/л, когда верхушки сразу начинали чернеть и гибли. Верхушки, выращиваемые на среде с концентрацией 0,1 мг/л 6-БАП развивались очень медленно. Самые лучшие результаты были достигнуты на среде с концентрацией 0,5…1,0 мг/л. (табл. 1).
Таблица 1
Влияние 6-БАП на развитие одноглазковых черенков винограда в условиях in vitro (см)
| Сорта | Концентрация, мг/л | НСР05 | ||||
| 0,1 | 0,5 | 1 | 2 | 5 | ||
| Восторг | 5,0 | 9,9 | 10,6 | 7,2 | 0,0 | 1,84 |
| Кодрянка | 5,1 | 11,5 | 11,9 | 7,9 | 0,0 | 2,06 |
| Лакхеди мезеш | 4,3 | 7,4 | 10,5 | 4,8 | 0,0 | 1,67 |
| Подарок Магарача | 4,4 | 7,0 | 9,2 | 5,0 | 0,0 | 1,56 |
| Виорика | 4,6 | 8,2 | 11,5 | 5,8 | 0,0 | 2,18 |
| Ркацители | 4,9 | 9,1 | 11,8 | 6,1 | 0,0 | 2,35 |
Влияние 6-БАП на развитие одноглазковых черенков винограда в условиях in vitro
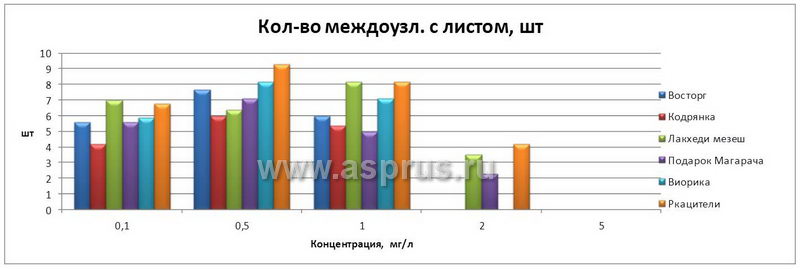
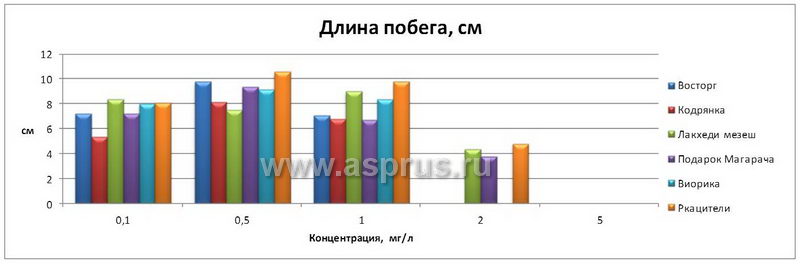
Другим веществом, обладающим цитокининовой активностью, явился препарат ДРОП. Действие препарата, оказываемое им на развитие экспланта — микропобегов различных сортов винограда (чем больше междоузлий с листом, тем больше и коэффициент размножения). Наиболее существенные различия в степени развития микропобегов винограда in vitro были обнаружены в варианте, содержащем ДРОП в концентрации 0,5 мг/л (табл. 2).
Число междоузлий с листом, развивающихся на микропобегах in vitro, помещенных на среды с разными концентрациями ДРОП, не имело существенных различий, кроме варианта, где уровень концентрации ДРОП был равен 0,1 мг/л. В этом случае отмечено максимальное число междоузлий с листом. В варианте опыта с высокой концентрацией ДРОП 2,0 и 5,0 мг/л было отмечено аномальное развитие микропобегов.
Таблица 2
Развитие микропобегов винограда на среде, содержащей ДРОП
| Сорта | Показатели | Концентрация, мг/л | НСР05 | ||||
| 0,1 | 0,5 | 1 | 2 | 5 | |||
| Восторг | Кол-во междоузл. с листом, шт | 5,6 | 7,7 | 6,0 | — | — | |
| Длина побега, см | 7,2 | 9,8 | 7,1 | — | — | 1,36 | |
| Кодрянка | Кол-во междоузл. с листом, шт | 4,2 | 6,0 | 5,4 | — | — | |
| Длина побега, см | 5,4 | 8,2 | 6,8 | — | — | 1,20 | |
| Лакхеди мезеш | Кол-во междоузл. с листом, шт | 7,0 | 6,4 | 8,2 | 3,5 | — | |
| Длина побега, см | 8,4 | 7,5 | 9,0 | 4,4 | — | 1,48 | |
| Подарок Магарача | Кол-во междоузл. с листом, шт | 5,6 | 7,1 | 5,0 | 2,3 | — | |
| Длина побега, см | 7,2 | 9,4 | 6,7 | 3,8 | — | 1,87 | |
| Виорика | Кол-во междоузл. с листом, шт | 5,9 | 8,2 | 7,1 | — | — | |
| Длина побега, см | 8,0 | 9,2 | 8,4 | — | — | 1,02 | |
| Ркацители | Кол-во междоузл. с листом, шт | 6,8 | 9,3 | 8,2 | 4,2 | — | |
| Длина побега, см | 8,1 | 10,6 | 9,8 | 4,8 | — | 1,64 | |
При добавлении в питательную среду 2-изопептиладенина (2-ip) цитокининого характера действия отмечаются существенные различия в росте побега и количестве междоузлий в вариантах с концентрацией 0,5 мг/л и 1,0 мг/л, особенно следует выделить концентрацию 0,5 мг/л (табл. 3).
Таблица 3
Развитие микропобегов винограда на среде MS, содержащей 2-изопентиладенин (2-ip)
| Сорта | Концентрация, мг/л | НСР05 | ||||
| 0,1 | 0,5 | 1 | 2 | 5 | ||
| Восторг | ||||||
| Кол-во междоузл. с листом, шт | 4,4 | 7,3 | 7,7 | 5,2 | — | |
| Длина побега, см | 5,6 | 10,5 | 9,1 | 6,0 | — | 1,84 |
| Кодрянка | ||||||
| Кол-во междоузл. с листом, шт | 4,8 | 8,1 | 8,2 | 4,6 | — | |
| Длина побега, см | 6,0 | 9,8 | 10,9 | 5,1 | — | 1,57 |
| Подарок Магарача | ||||||
| Кол-во междоузл. с листом, шт | 3,7 | 6,2 | 6,1 | 4,0 | — | |
| Длина побега, см | 5,8 | 8,4 | 8,0 | 5,2 | — | 1,32 |
| Виорика | ||||||
| Кол-во междоузл. с листом, шт | 5,1 | 8,9 | 6,2 | 5,4 | — | |
| Длина побега, см | 6,4 | 10,8 | 7,3 | 6,2 | — | 1,68 |
Фаза удлинения кластер-побегов
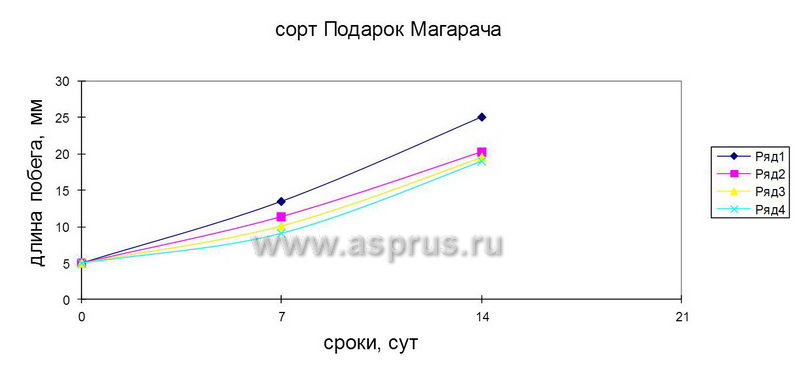
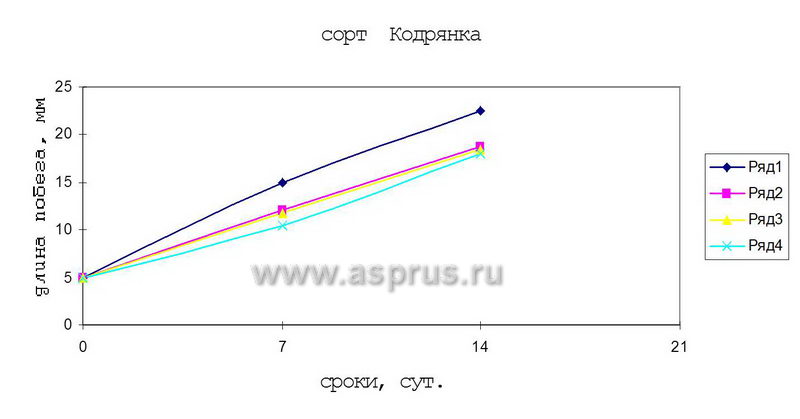
Для ускорения процесса удлинения кластер-побегов проводили изучение действия гибберелловой кислоты в различных концентрациях в сочетании 6-БАП. Как показал опыт, при сочетании 0,5 мг/л 6-БАП + 1,0 мг/л ГК был достигнут наилучший результат. Такое сочетание препаратов ускоряло вытягивание стеблей у растений, и через две недели размер побегов достигал 25…26 мм.
Таким образом, проведенные нами эксперименты показали эффективное действие ГК и пониженной концентрации 6-БАП для удлинения побегов перед этапом укоренения.
Динамика развития побегов винограда на средах, содержащих 6-БАП и его сочетаний с ГК
- 0,5 мг/л 6-БАП + 1,0 мг/л ГК
- 0,5 мг/л 6-БАП
- 0,5 мг/л 6-БАП + 2,0 мг/л ГК
- 0,5 мг/л 6-БАП + 5,0 мг/л ГК
- 0,5 мг/л 6-БАП + 1,0 мг/л ГК
- 0,5 мг/л 6-БАП
- 0,5 мг/л 6-БАП + 2,0 мг/л ГК
- 0,5 мг/л 6-БАП + 5,0 мг/л ГК
Выводы
Проведенные исследования показали возможность успешного размножения испытуемых сортов винограда методом культуры изолированных тканей и органов in vitro, что объясняется высокой потенциальной способностью винограда к вегетативному размножению вообще и к микроклональному в частности.
Приживаемость апикальных меристем, из которых вырастает растение in vitro (10-12 см), дает возможность дальнейшего их культивирования и размножения (путем повторного черенкования), при котором возможно получение безвирусного посадочного материала.
Из испытанных регуляторов роста наиболее результативно проходила регенерация побегов при концентрации 6-БАП 0,5…1,0 мг/л. При массовом размножении побегов оптимальной оказалась концентрация 6-БАП 2 мг/л.
Действие ГК в концентрации 1,0 мг/л в сочетании с 6-БАП 0,5 мг/л, ускоряло вытягивание стеблей у микрорастений in vitro.
Присутствие кинетина в питательной среде в комбинации с 6-БАП положительно влияло на развитие эксплантов. Так, на фоне концентрации 6-БАП 0,5 мг/л присутствие кинетина (0,5 мг/л) обеспечило максимальный коэффициент размножения для испытываемых сортов винограда
<



 ЕЖЕДНЕВНЫЙ ИНТЕРНЕТ-ЖУРНАЛ
ЕЖЕДНЕВНЫЙ ИНТЕРНЕТ-ЖУРНАЛ  КОММЕРЧЕСКИЕ ПРЕДЛОЖЕНИЯ
КОММЕРЧЕСКИЕ ПРЕДЛОЖЕНИЯ