Д.Н. Сковородников, И.В. Казаков
ФГОУ ВПО Брянская ГСХА E-mail: skovorodnikov_d@mail.ru
УДК 634.1:631.527.8:581.143.6
В работе представлены результаты многолетних исследований по клональному микроразмножению ремонтантных форм малины, созданных на Кокинском опорном пункте ВСТИСП. Выявлены способы получения генетически однородного потомства селекционных форм, позволяющие существенно оптимизировать их размножение и ускорить создание новых сортов малины. Предложены способы преодоления ряда проблем, возникающих при размножении растений на отдельных этапах культивирования in vitro.
Ключевые слова: малина, клональное микроразм-ножение, культура тканей, регуляторы роста растений.
Особенности клонального микроразмножения ремонтантных форм малины
Введение
Ремонтантные формы малины — уникальные ягодные растения, способные в отличие от обычных растений малины плодоносить на однолетних побегах. Лучшие из современных сортов ремонтантного типа обладают высокой урожайностью, крупноплодностью, экологической адаптивностью, пригодны к низкозатратным технологиям возделывания. Однако многие ремонтантные формы малины обладают низким потенциалом вегетативного размножения по сравнению с летними сортами, что затрудняет их размножение и использование в селекционном процессе [3].
Решить проблему ускоренного размножения ценного селекционного материла стало возможным благодаря применению метода клонального микроразмножения. По сравнению с традиционными способами размножения малины — корневыми отпрысками, корневыми и зелеными черенками, этот способ имеет целый ряд несомненных преимуществ. Главные из них высокий коэффициент размножения и возможность оздоровления посадочного материала от ряда вредоносных микроорганизмов, в том числе и от вирусной инфекции.
За последние десятилетия в нашей стране и за рубежом были проведены многочисленные иссле-дования по совершенствованию метода клонального микроразмножения с целью производства высококачественного посадочного материала малины [5, 14]. Выполненные работы позволили определить оптимальные сроки изолирования эксплантов, оптимизировать состав питательных сред, отработать приемы адаптации полученных растений к нестерильным условиям выращивания. В настоящее время этот метод стал рутинным при тиражировании ценного селекционного материала малины в некоторых селекционных программах [7].
Однако биологические особенности ремон-тантных форм малины, связанные с их сложным межвидовым происхождением, стали причиной низкой эффективности предлагаемых биотехно-логических методов размножения малины на не-которых этапах культивирования in vitro. В связи с этим возникла необходимость оптимизации процесса клонального микроразмножения новых ре-монтантных форм малины.
Материалы и методы исследования
Весь селекционный материал ремонтантной малины (220 генотипов), используемый нами в работе, был создан на Кокинском опорном пункте ВСТИСП (Брянская обл.). Исследования проводились в Научно-образовательном центре биотехнологии Брянской ГСХА.
Изолирование эксплантов осуществляли в конце лета — начале осени, либо в осенний период. Заготовленные побеги хранили в бытовом холодильнике, при температуре 4 °С. Сегменты стебля с почкой стерилизовали в 0,1 % растворе сулемы (HgCl2) или 0,1 % мертиолята (C9H9HgNaO,S) в течение 3 минут с последующей пятикратной промывкой в стерильной дистиллированной воде. Культивирование первичных эксплантов и последующее размножение осуществляли в модифицированной среде Мурасиге-Скуга [10] с увеличенной в 3 раза концентрацией хелата железа. На этапе введения в культуру in vitro в качестве источника цитокинина вводили 6-бен- зиламинопурин (6-БАП) 0,5 мг/л, тидиазурон (TDZ) в концентрации 0,05-0,2 мг/л, N-(2 хлор- 4-пиридил)-Ы-фепилмочевина (CPPU) в концентрации 0,2-1 мг/л. При размножения растений изучали влияние цитокининов 6-БАП в концентрациях 0,5-2 мг/л и TDZ в концентрации 0.05, 0.1 и 0.2 мг/л.
На этапе укоренения использовали часть минеральной среды Мурасиге-Скуга. В качестве индукторов ризогенеза в среду вводили ПУК или ИМК.
Результаты и обсуждения
Оптимальным сроком введения в культуру in vitro большинства ягодных растений, в том числе и малины, является период активного роста побегов — конец мая, начало июня. Эффективность начального этапа культивирования в эти сроки выявлена и на ремонтантных формах малины [4]. Однако при введении в культуру генотипов малины in vitro в весенне-летний период возникает ряд трудностей. Во-первых, ограниченное число подходящих почек, которые можно использовать для изолирования от побегов. Так, при введении в культуру 28 новых генотипов в весенне-летний период в среднем на каждый приходилось лишь 13 эксплантов. При таком ограниченном количестве материала есть вероятность потери некоторых генотипов из-за контаминации культуры и/пли не- приживаемости эксплантов. Во-вторых, у ремонтантной малины наблюдается ранняя дифферен- цировка почек по цветочному типу, что снижает эффективность применения стандартных методов культивирования. В-третьих, есть вероятность появления сортосмеси при заготовке побегов возобновления при загущенных посадках гибридов.
В настоящее время изолирование эксплантов ремонтантных генотипов малины проводится нами в осенний период, сразу после их селекционной оценки. Однако большинство почек у малины в это время дифференцированы по цветочному типу и при их культивировании на стандартных средах (0,2-0,5 мг/л 6-БАП) отмечается гибель большей части материала. Рост степени приживаемости эксплантов и регенерации растений при введении в культуру в осенний период удалось достичь, используя в качестве источника цитокинина производные дифенилмочевины — тидиазурон и CPPU, которые в низких концентрация (0.1-0.2 мг/л) оказались более эффективными, чем фитогормоны пуринового ряда.
Введение растений малины в культуру in vitro осенью дает возможность начать размножение нужных форм сразу после проведения селекционной оценки и тем самым сократить период их раз-множения. При этом даже в загущенных посадках сеянцев малины интересующий селекционера генотип легко обнаружить при его плодоношении и использовать для изолирования экспланты от нераспустившихся почек с побегов замещения. Кроме этого, при изолировании крупных почек, сформировавшихся на однолетних побегах, быстрее чем в весенний период, происходит регенерация растений, а плотные ороговевшие чешуи почек надежно защищают ткани от повреждения антисептиками при стерилизации.
Установлено, что производные дифенилмочевины в определенной степени стимулируют развитие цветочных структур в условиях in vitro. Так, в зависимости от фазы дифференцировки почек, нередко отмечается появление одного или нескольких бутонов и, как исключительное явление, их распускание. Однако дальнейшего своего развития эти цветочные образования не получают и со временем усыхают, тогда как регенерировавшие побеги сохраняют активный рост.
Регенерация побегов из пазушных почек про-исходит по периферии их основания из запасных меристем. В среднем образуется около 2 побегов на эксплант. Нами установлено, что при использовании в качестве эксплантов цветочных зачатков возможна адвентивная регенерация из них побегов. Однако в связи с возможным появлением сомаклональных вариантов при таком типе регенерации [2] его необходимо применять лишь в исключительных случаях.
Известно, что регенерационный потенциал на-ходится в прямой зависимости от его генотипа. Так, в ряде исследований продемонстрировано, что среди представителей рода Rubus ежевика отличается большим, чем малина, коэффициентом размножения in vitro, а также частотой регенерации при адвентивном органогенезе [12]. Среди представителей одного вида растений могут вы-делятся сорта как с большей, так и с меньшей регенерационной способностью. Возможно, что признаки, определяющие способность к размно-жению у растений in vitro, коррелируют с такими показателями в полевых условиях. Однако основа-тельных экспериментов, подтверждающих это на ремонтантных формах малины, не проводилось, несмотря на актуальность такой информации при планировании работы по тиражированию сортов с использованием культуры ткани. В наших исследо-ваниях при включении большого количества гено-типов было зафиксировано, что высокорослые, ак-тивно растущие в полевых условиях сорта ремон-тантной малины сохраняют такую же способность и в условиях in vitro. Так, из межвидовых сортов ремонтантной малины большим коэффициентом размножения и способностью к ризогенезу in vitro отличается сорт Бабье лето-2, а у трудно укореняе-мого in vitro сорта Геракл в полевых условиях наряду с низкорослыми побегами образуется слабая по сравнению с другими сортами корневая система. Такую же аналогию можно провести между низко-рослым сортом Пингвин, который отличается от-носительно низким коэффициентом размножения в естественных условиях, и высокорослым, активно растущим сортом Оранжевое чудо.
Среди сортов, выделенных из сотен элитных сеянцев нами не было отмечено генотипа, который бы не поддавался удовлетворительному размножению in vitro на стандартных средах с 6-БАП (1-2 мг/л). Однако выделялись генотипы, обладающие очень низкими коэффициентами размножения (не более 2): 6-Х-Ж, 15-220-2 и 16-67-1.
Из существующих способов увеличения коэф-фициента размножения малины можно выделить следующие:
- повышение концентрации применяемого ци- токинина. Как правило, рост содержания 6-БАП в среде приводит к образованию большего количества дополнительных побегов. Для малины максимальная концентрация не должна превышать 3 мг/л. Чрезмерно высокие концентрации цитоки- нинов приводят к образованию побегов с морфо-логическими нарушениями, которые проявляются в виде коротких деформированных побегов, скру-ченных листьев, стекловидных органов с признаками гипероводненности;
- последовательное чередование высоких и низких концентраций 6-БАП [8];
- использование в качестве источника цито- кинина производных дифенилмочевины [1], которые в более низких концентрациях способны вызывать пролиферацию побегов. Превышение оптимальных концентраций цитокининов ряда дифенилмочевины приводит к появлению морфо-логических нарушений у растений, более суще-ственных, чем 6-БАП.
Не исключено, что новыми способами индукции образования дополнительных побегов могут быть и другие химические и физические факторы.
Из испытанных питательных сред, приготовлен-ных по прописям Мурасиге-Скуга [10], Андерсона [6] и Ли и де Фоссарда [9], первая оказалась наиболее оптимальной для культивирования малины на этапах введения в культуру, собственно размножения и укоренения (1/2 часть). Среда Мурасиге- Скуга (МС) использовалась в большинстве случаев при размножении малины in vitro. Однако следует учитывать, что эта среда в нашей работе содержит тройную концентрацию хелата железа по сравнению с оригинальной прописью.
Среди физических факторов критическое влияние на культивирование малины in vitro оказывает температура. Высокие значения этого показателя (около 30 °С), отмечаемые в весенне-летний период в отсутствии кондиционирования, могут привести к значительным потерям растительного материала. При воздействии высоких температур происходит интенсивное выделение растительными тканями этилена и углекислоты, которые в изолированной системе in vitro накапливаются в высоких концентрациях. Этилен, являясь гормоном старения и созревания, приводит к быстрой гибели растений, особенно уже закончивших рост. В связи с этим при выращивании растений in vitro целесообразно искусственно поддерживать оптимальную температуру в культивационном помещении или избегать размножения растений в жаркие месяцы. Несомненный интерес представляет информация, связанная с определением оптимальных температур и термопериода для культивирования растений малины на каждом этапе клонального микроразмножения. В большинстве случаев в научных работах рекомендуют культивирование растений малины при температуре 20-22 °С [13].
Традиционно для индукции ризогенеза микро-черенков малины используются ауксины ИУК, ИМК и реже НУК. На средах с ИУК укореняются лишь на 30-40 % микрочеренков, и для них более эффективна ИМК (0,5 мг/л).
Для некоторых плохо укореняемых генотипов ремонтантной малины предложен метод укоренения без инкубации на средах с ауксинами. После обмакивания основания стебля в концентрированный раствор ауксинов (1мг/л) растения переносятся на безгормональную среду, что приводит к высокому уровню индукции ризогенеза — до 100 %.
Перспективное направление в получении по-садочного материала малины — укоренение микро-побегов длиной до 2 см непосредственно в субстрате, минуя стадию укоренения в пробирке. Для индукции ризогенеза нами применяется ИМК в концентрации 1 г/л в течение 1 с.
Успех укоренения определяется качеством ис-ходных микрочеренков. Установлено, что доля укорененных растений у крупных побегов выше, чем у мелких. Поэтому между этапами размножения и укоренения вводится дополнительный этап элонгации (удлинения побегов). На нем проводят уменьшение концентрации цитокинина 6-БАП с 1-2 мг/л до 0,2-0,3 мг/л.
Для ускорения ростовых процессов в лаборатории проведен эксперимент по влиянию вита- минно-минерального комплекса «Компливит» на элитные формы ремонтантной малины. Полученные результаты позволяют заключить, что введение в питательную среду МС витамин- но-минерального комплекса «Компливит» (4 г/л) приводит к росту коэффициента размножения и высоты растений. Такой эффект очень важен на последнем в субкультивировании этапе элонгации для получения более крупных побегов.
Высадка размноженных растений с последующей адаптацией их к нестерильным условиям является заключительным и наиболее ответственным этапом, который определяет значительную часть успеха размножения растений in vitro. В связи с рядом особенностей пробирочных растений (слабым функционированием устьичного аппарата, отсутствием кутикулярного слоя и корневых волосков) может наблюдаться значительные потеря высаженного в субстрат материала [11]. Нами установлено, что на приживаемость растений малины большое влияние оказывают тип субстрата, его pH, влажность и температура воздуха.
В своей работе мы практикуем высадку и/или укоренение пробирочных растений в минипарниках для рассады, состоящих из общего поддона, кассет и полупрозрачной крышки, обеспечивающей высокую влажность среды. Кассеты заполняются готовым торфяным субстратом. Ежедневно проводится опрыскивание растений и полив по мере необходимости.
После одного-двух месяцев адаптации в ми-нипарниках, укорененные растения малины с не-сколькими образовавшимися листочками распи-кировываются в ящики и помещаются в теплицу, покрытую нетканым материалом типа «Лутрасил» для адаптации к естественным условиям. В таком случае отсутствует парниковый эффект, в тоже время растения защищены от воздействия низких температур, что способствует лучшему развитию растений.
Литература
- Высоцкий В.А. Особенности клонального ми-кроразмножения некоторых форм ремонтантной малины // Плодоводство и ягодоводство России: Сб. научных трудов ВСТИСП. — М., 1996. Т.З. — С. 90-95.
- Высоцкий В.А. О генетической стабильности при клональном микроразмножении плодовых и ягодных культур // Сельскохозяйственная биология, 1995. №5.-С. 57-63.
- Казаков И.В., Евдокименко С.Н. Малина ремонтантная. ГНУ ВСТИСП. М. 2007. — 288 с.
- Нам И.Я., Заякин В.В., Вовк В.В. и др. Оптимизация метода клонального микроразмножения для ускоренной селекции межвидовых ремонтантных форм малины // Сельскохозяйственная биология, 1998.-№3.-С. 51-56.
- Туровская Н.И., Стрыгина О.В. Микро- клональное размножение малины // Садоводство и виноградарство, 1990. -№ 8. — С. 26-29.
- Anderson W.C. Tissue culture propagation of red and black raspberry, Rubus idaeus and Rubus occidentalis. //Acta Horticulture, 1980.-V. 112.-P. 13-20.
- Hall H., Hummer K.E., Jaimieson A., and others. Plant Breeding Reviews: Raspberry Breeding and Genetics. New Jersey: Wiley Blackwell, 2009. — 32. — P. 39-382.
- Jin-Hu Wu, Shirley A. Miller, Harvey K. Hall and Pauline A. Mooney //Factors affecting the efficiency of micropropagation from lateral buds and shoot tips of Rubus Plant Cell, Tissue and Organ Culture. — 2009. Vol. 99. — № 1,P. 17-25.
- Lee E.C.M., Fossard R.A. Regeneration of strawberry plants from tissue cultures // Comb. Proc. (Intern. Plant Propagators Soc. Miltown, N.-Y.). — 1975. V. 25. — P. 277-285.
- Murashige Т., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Physiologia Plantamm. 1962. — V. 15. — № 13. P. 473-497.
- Pierik R.L.M. In vitro culture of higher plants. 1987.-V. 5.-344 p.
- Reed B.M. Multiplication of Rubus germplasm in vitro a screen of 256 accessions. // J. Amer. Soc. Hort. Sci, 1990. — V. 44. — № 3. — P. 141-148.
- Turk B.A., Swartz H.J., Zimmerman R.H. Adventitious shoot regeneration in vitro-cultured leaves of Rubus genotypes // Plant Cell. Tiss. Org. Cult, 1994. — V. 38.-P. 11-17.
- Wellander M. In vitro culture of red raspberry (Rubus idaeus) for mass propagation // Journal of Horticulture Science, 1985 — V. 60. — P. 493-499.


 ЕЖЕДНЕВНЫЙ ИНТЕРНЕТ-ЖУРНАЛ
ЕЖЕДНЕВНЫЙ ИНТЕРНЕТ-ЖУРНАЛ  КОММЕРЧЕСКИЕ ПРЕДЛОЖЕНИЯ
КОММЕРЧЕСКИЕ ПРЕДЛОЖЕНИЯ 





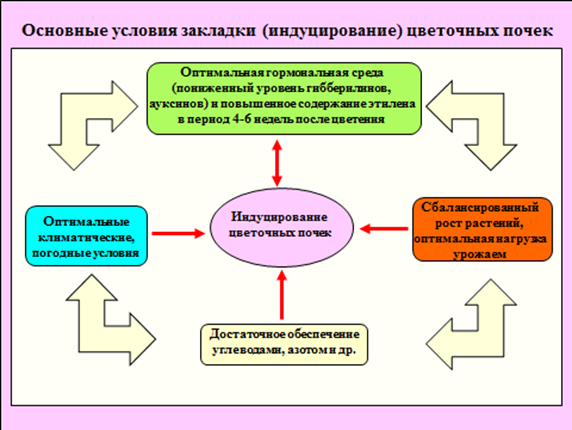 Рис. 1. Основные условия закладки (индуцирование) цветочных почек.
Рис. 1. Основные условия закладки (индуцирование) цветочных почек. Рис. 2. Основные потребители (конкуренты) ассимилятов, запасных веществ.
Рис. 2. Основные потребители (конкуренты) ассимилятов, запасных веществ.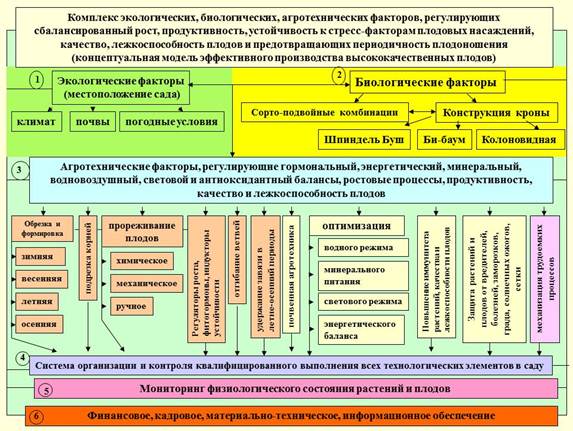 Рис. 3. Комплекс факторов, обеспечивающих стабильность плодоношения и высокое качество плодов.
Рис. 3. Комплекс факторов, обеспечивающих стабильность плодоношения и высокое качество плодов.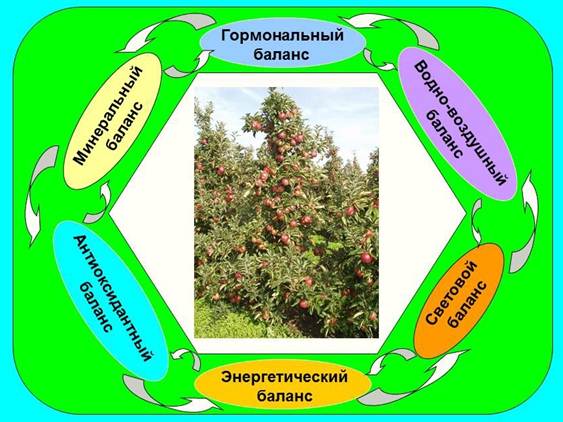 Рис. 4. Физиологическая модель предотвращения периодичности, стабилизации продуктивности насаждений, их устойчивости к неблагоприятным факторам среды, повышения качества плодов в саду и его сохранения при хранении и доведении до потребителя.
Рис. 4. Физиологическая модель предотвращения периодичности, стабилизации продуктивности насаждений, их устойчивости к неблагоприятным факторам среды, повышения качества плодов в саду и его сохранения при хранении и доведении до потребителя.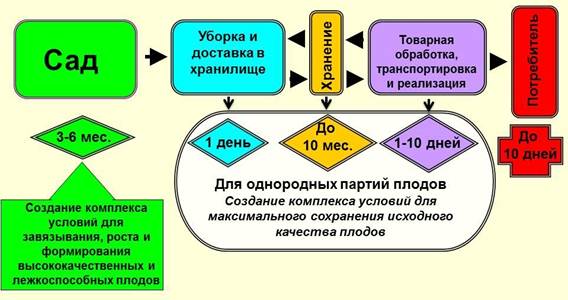 Рис. 5. Основные этапы и условия жизни плодов и продвижения их до потребителя.
Рис. 5. Основные этапы и условия жизни плодов и продвижения их до потребителя.







